PREGUNTES:
1-Què és un alt forn ? On estaven ubicats els alts forns ? Tipus de forns?
-L'alt forn és la instal·lació industrial on es transforma o treballa el mineral de ferro.
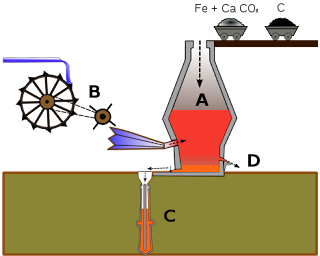
- A les industrias
- Forns de calç, de llenya, de gas, electrics...
2-Quin any varen ser fundats ?
- Al primer forn va ser fundat al 1848 a Asturias i al 1859 a la Felguera.
3-Quantes empreses i quins tipus formaven el grup?
- Tres empreses, Altos Hornos y Fábricas de Hierro y Aceros de Bilbao, La Vizcaya i La Iberia. Eren empreses metal·lúrgiques.
4-Quins son els principals productes que fabriquen ?
- Ferro colat: És el producte pròpiament aprofitable de l'alt forn i està constituït per ferro amb un contingut en carboni que varia entre el 2% i el 5%. Dintre de la massa de ferro, el carboni pot trobar-se en tres formes o estats diferents: en estat lliure, formant grafito; en estat combinat, formant carbur de ferro; o dissolt. A partir de la primera fusió, s'obtenen tots els productes ferrosos restants: altres foses, ferro dolç, acer...
5-D’on prové la paraula ferro ?
- La paraula ferro probé del llatí "ferrum".
- Bibliografia
6-Desde quan l’home coneix el ferro?
- 2 o 3 mil·lenis abans de Crist.
7-De quins minerals s’obté el ferro ?
- La siderita (FeCO3), la pirita (FeS2), la ilmenita (FeTiO3), l'hematites (Fe2O3), la magnetita (Fe3O4), la limonita (FeO(OH)), etc.
8-Elabora un diagrama en blocs on es representin les fases de l’obtenció del ferro?

9-Quines son las propietats físiques i químiques més importants del ferro? Quin es el seu punt de fusió?
- Químicament el ferro és un metall actiu. Es combina amb els halògens (flúor, clor, brom, iode i àstat i amb el sofre, fòsfor, carboni i silici. Desplaça a l'hidrogen de la majoria dels àcids febles. Crema amb oxigen formant tetróxido triférrico (òxid ferrosoférrico), Fe3O4. Exposat a l'aire humit, es corroïx formant òxid de ferro hidratat, una substància marró-vermellosa, escamosa, coneguda comunament com orín. La formació de orín és un fenomen electroquímic en el qual les impureses presents en el ferro interactuen elèctricament amb el ferro metall. S'establix un petit corrent en la qual l'aigua de l'atmosfera proporciona una dissolució electrolítica. L'aigua i els electròlits solubles acceleren la reacció. En aquest procés, el ferro metàl·lic es descompon i reacciona amb l'oxigen de l'aire per a formar el orín. La reacció és més ràpida en aquells llocs on s'acumula el orín, i la superfície del metall acaba foradant-se. Al submergir ferro en àcid nítric concentrat, es forma una capa d'òxid que ho fa passiu, és a dir, no reactiu químicament amb àcids o altres substàncies. La capa d'òxid protectora es trenca fàcilment copejant o sacsejant el metall, que torna a convertir-se en actiu. És un metall més aviat inestable ja que es oxida rapidamente en compostos ferricos. Les pirites estan constituïdes per un disulfurode ferro que existeix en la naturalesa de color groc brillant. Es pot utilitzar per a preparar sulfat terroso, cridat vulgarment vitreolo verd o cendra de coure 2FES2 + 702 + 2H2O 2FeSO4 + 2H2SOTA4. disulfur de sulfat ferroso ferro Part del sulfur de ferro es transforma en sulfat ferroso i part es oxida transformant-se en àcid sulfúric. Tambien les limaduras de ferro es dissolen en àcid sulfúric formant el sulfat. Fe + H2 SOTA4 FeSO4 + H2. El sulfat ferroso es oxida fàcilment i s'utilitza en la pureficación de l'aigua, convertiéndose en hidròxid fèrric, com esmentarem després. Entre els usos del sulfat ferroso es poden citar els de mordientes en els tints, matèria primera per a la manufactura d'altres compostos de ferro i la fabricació de tintes. La sal és introduïda amb àcid tánico en la tinta per a formar tanato ferroso, compost incolor, estable en solució àcida. A l'aplicar-la sobre el paper l'alcalinitat d'aquest (particularment si el aprestro aquesta carregat amb carbonat de de calci) acompanyat per l'exposició a l'aire, transforma el tanato ferroso en tanato fèrric, que és negre. En la tinta blava negra, s'afegix un tint blau soluble en l'aigua per a donar a la tinta un color previ abans que es formi el compost de ferro acolorit. Aquest es transforma en òxid fèrric a l'envellir. Per tant per a llevar taques de tinta d'aquesta classe caldrà eliminar prèviament el compost fèrric present, per a això s'utilitza comunmente un agent reductor, tal que una solució d'àcid oxálico que al reaccionar forma un compost ferroso incolor que, per ser soluble, pot ser eliminat fàcilment. Es poden canviar directament limaduras de ferro amb iode per a formar iodur ferroso, FeI2. Fe + I2 FeI2. S'utilitza aquesta sal per a la formació d'altres iodurs metàl·lics i en farmàcia. El fosfat ferroso, Fe3 (PO4)2, existeix en la naturalesa i pot ser produït per la reacciión del sulfat ferroso amb sulfat trisódico. 3FeSO4 + 2Na3PO4 3Na2SOTA4 + Fe3(PO4)2. TAULA DE PROPIETATS FÍSIQUES SIMBOLO Fe Nombre Atòmic 26. Pes Atòmic 55.847 Estructura Electrònica %[Ar] 3d64s2. Estat Oxidació 2,3 Electronegatividad 1,8 Volum Atòmic 7,1 Ràdio Atòmic 1,26 Ràdio Iònic 0,76 %[2+] 0,64%[3+] Ràdio Covalent 1,17 Calor Específica 0,11 Potencial d'Ionització 7,90 Temperatura de Fusió 1.536 Temperatura Ebullició 2.740 Densitat 7,87gr/mol
- 1808 K
10-Busca en un diccionari el significat de la paraula acritud.
- Qualitat d’un metall que ha esdevingut poc mal·leable o trencadís a causa de l’augment de mida dels cristalls.
11-Propietats del ferro , fes una petita descripció?
- El ferro pur té una duresa que oscil·la entre 4 i 5. És tou, maleable i dúctil. Es magnetiza fàcilment a temperatura ordinària; és difícil magnetizarlo en calenta, i a uns 790 °C desapareixen les propietats magnètiques. Té un punt de fusió d'uns 1535 °C, un punt d'ebullició de 2750 °C i una densitat relativa de 7,86. La seva massa atòmica és 55,847. El metall existeix en tres formes alotrópicas distintes: ferro ordinari o ferro- (ferro-alfa), ferro- (ferro-gamma) i ferro- (ferro-delta). La disposició interna dels àtoms en la xarxa del cristall varia en la transició d'una forma a una altra. La transició de ferro- a ferro- es produïx a uns 910 °C, i la transició de ferro- a ferro- es produïx a uns 1.400 °C. Les diferents propietats físiques de les formes alotrópicas i la diferència en la quantitat de carboni admesa per cadascuna de les formes ocupen un paper important en la formació, duresa i tremp de l'acer.
12-Quins son els aliatges més importants del ferro? Quina diferencia fonamental hi ha? Amb quins percentatges?
- Fosa : ferro + carboni (des del 2,1% fins el 6.7% de carboni)
- Acer : ferro + carboni (menys del 2,1% de carboni)
- Acer inoxidable : ferro + níquel + crom, i de vegades molibdè o vanadi l.
13-Resumeix els avantatges e inconvenients que ofereixen els aliatges en comparació del ferro pur.
- Acer baix en carboni. Menys del 0.25% de C en pes. Són tous però dúctils. Acer mig en carboni. Entre un 0.25% i un 0.6% de C en pes. Per a millorar les seves propietats són tractats tèrmicament. Acer alt en carboni. Entre un 0.60% i un 1.4% de C en pes. Són encara més resistents, però també menys dúctils.
14-Explica breument el procés d’obtenció d’un tub de ferro?

1. Es fon el mineral de ferro.
2. Es posa el material semilíquid al motlle-recipient, el qual permetrà obtenir la forma desitjada.
3. Es deixa endurir i es treu llest per a la seva utilització.
15-Es pot reciclar el ferro? Amb quin tipus de forn es pot realitzar? Es depuren els fums dels forns? Com ?
- Si.
- Amb forns d'acer capaços d'arrivar a altes temperatures.
- Si.
- Del ferro no hem trobat informació sobre la depuració dels fums que produeix però a la pàgina següent es mostra com depurar els fums del coure.
Depuració dels fums del coure
Oriol Solanich

